Оксидлашу-кайтару реакцияләре

Оксидлашу-кайтару реакцияләре яки Редокс (инглизчә redox, reduction-oxidation - яңадан кайтару-оксидлашу сүзеннән) - электроннар яңача бүлү ике атом арасында баручы каршы химик реакцияләре: оксидлаштыручы атом электроннарны ала, ә кайтаргыч атом үз электроннарын бирә. Реакция барышында оксидлашу дәрәҗәсе үзгәрә, берьюлы оксидлашу һәм кайтару реакцияләре бара.
Оксидлашу

Оксидлашу барышында атом үз электроннарын бирә һәм аның оксидлашу дәрәҗәсе арта. Оксидлаштырылган атом - электроннар доноры, оксидлаштырган атом - электроннар акцепторы дип атала.
Кайбер очракта оксидлашкан молекула тотрыксыз була һәм тотрыклырак, вакрак өлешләренә - ирекле радикалларга таркала ала һәм югарырак оксидлашу дәрәҗәсенә ия була ала.
Яңадан кайтаргыч матдә электроннарын биреп, бәйләнгән оксидлаштыручыга әйләнә:
- кайтаргыч матдә — e− ↔ бәйләнгән оксидлаштыручы.
Бәйләнмәгән ирекле электрон бик көчле кайтаргыч матдә булып тора.
Яңадан кайтару
Яңадан кайтару барышында атом электроннарны алып тоташтыра һәм аның оксидлашу дәрәҗәсе кими.
Мисаллар:
- металлар оксидлары сутуар, күмер һ.б. матдә ярдәмендә ирекле металларга кайтарыла
- органик әчелекләр альдегидларга, спиртларга кайтарыла
- майлар гидрогенизациясе
Оксидлаштыручы электроннарны алып бәйләнгән кайтаргыч матдәгә әйләнә, процесс яңадан кайтару дип атала:
- Оксидлаштыручы + e− ↔ бәйләнгән кайтаргыч матдә.
Оксидлашу-кайтару пары
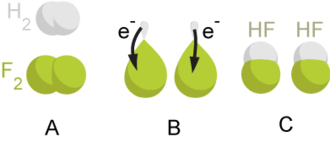
Оксидлаштыручы һәм аның кайтарылган форма яки кайтаргыч матдә һәм аның оксидлашкан формасы бәйләнгән оксидлашу-кайтару парын булдыра, ә аларның үзара әверелеше Оксидлашу-кайтару ярымреакцияләре дип атала.
Мисаллар
Сутуар һәм фтор арасында оксидлашу-кайтару ярымреакциясе
ике ярымреакциягә бүленә:
1) Оксидлашу:
2) Яңадан кайтару:
Электроннарны тоташтыру процессы - яңадан кайтару, шуннан оксидлашу дәрәҗәсе кими:
Әлеге реакциядә
- электроннарны тоташтыручы атомнар яки ионнар - оксидлаштыручылар булып торалар,
- электроннарны кайтаручы атомнар яки ионнар - кайтаргычлар булып торалар.
Әдәбият
- Хомченко Г. П., Севастьянова К. И., Окислительно-восстановительные реакции, 2 изд., М., 1980;
- Кери Ф., Сандберг Р., Углубленный курс органической химии, пер. с англ., кн. 2, М., 1981, с. 119-41, 308-43;
- Марч Дж., Органическая химия, пер. с англ., т. 4, М., 1988, с. 259—341;
- Турьяи Я. И., Окислительно-восстановительные реакции и потенциалы в аналитической химии, М., 1989;
- Тодрес 3. В., Электронный перенос в органической и металлоорганической химии, в сб.: Итоги науки и техники. Сер. Органическая химия, т. 12, М., 1989. С. И. Дракин, З. В. Тодрес.